科学的な解析(化学)を行う際には基本的に反応物質の電子式や構造式の理解が必要となることが多いです。
そのためさまざまな物質の電子式や構造式を理解しておくといいわけですが、なかなか覚えにくいものです。
中でもここでは常温にて気体(ガス)の代表といえるである一酸化炭素・窒素・酸素・水素・シアン化水素・二酸化炭素の電子式と構造式をまとめていきますので、参考にしてみてください。
一酸化炭素の電子式と構造式【CO】
まずはニ原子分子である「一酸化炭素」の電子式と構造式を確認していきます。
一酸化炭素(CO)の電子式(ルイス構造式)は以下の通りとなります。
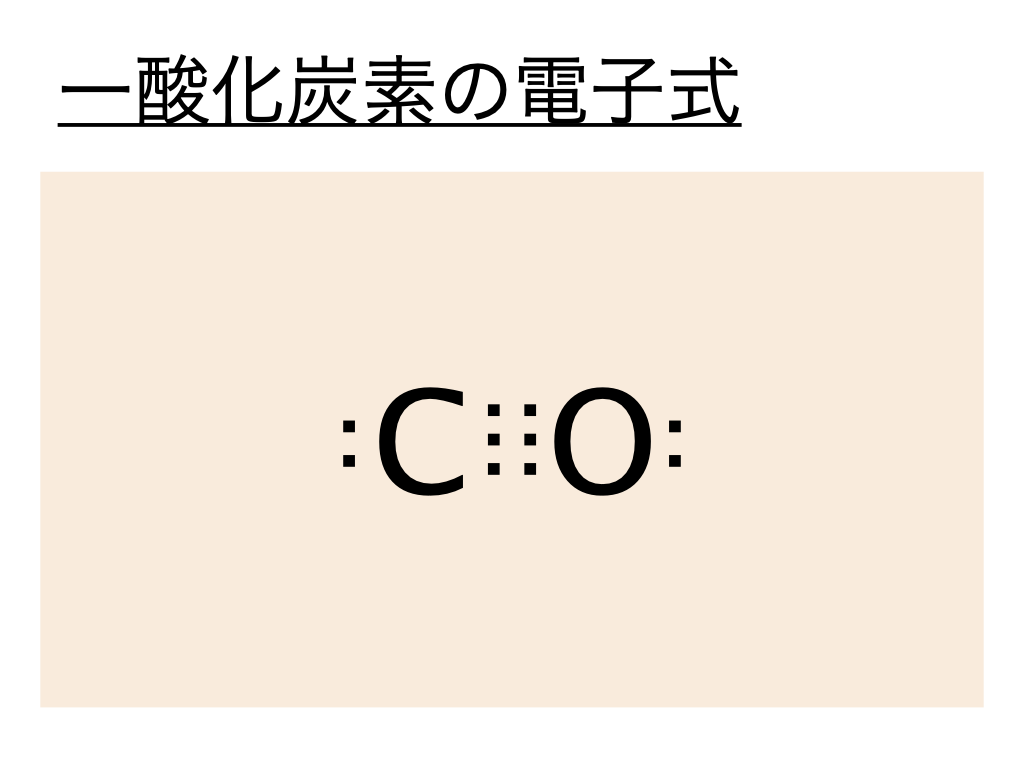
こちらは炭素Cの最外殻電子が4個、酸素Oの最外殻電子が6個であることから説明できます。
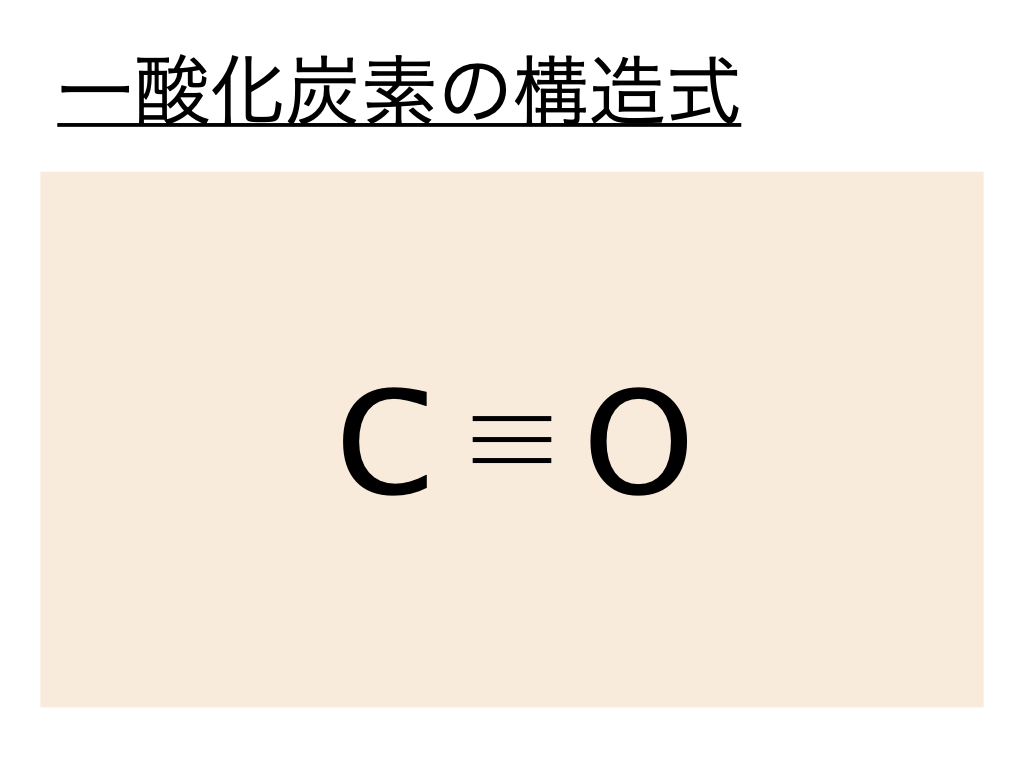
上と同様に一酸化炭素の構造式はこの電子式を元に考えるとよく、一酸化炭素の電子式では炭素と酸素の間の :(共有電子対)が3つ重なっていることから三重結合であることがわかります。本来酸素は2つの不対電子を使って共有電子対を作ります。しかし一酸化炭素の場合、酸素の持っていた非共有電子対のうち1つが量子化学的な理由により炭素側にひっぱられることで三重結合が生じています。
よって一酸化炭素(CO)の構造式は以下のようになるのです。
二酸化炭素の電子式と構造式【CO2とルイス構造式】
それでは以下で化学物質の二酸化炭素の電子式と構造式を確認していきます。
電子式(ルイス構造式)とは、最外殻にある電子の数を・に表すことによって分子内の各原子の種類や結合状態などを表すことができるものです。
そして二酸化炭素(CO2)の電子式は以下のように表すことができます。
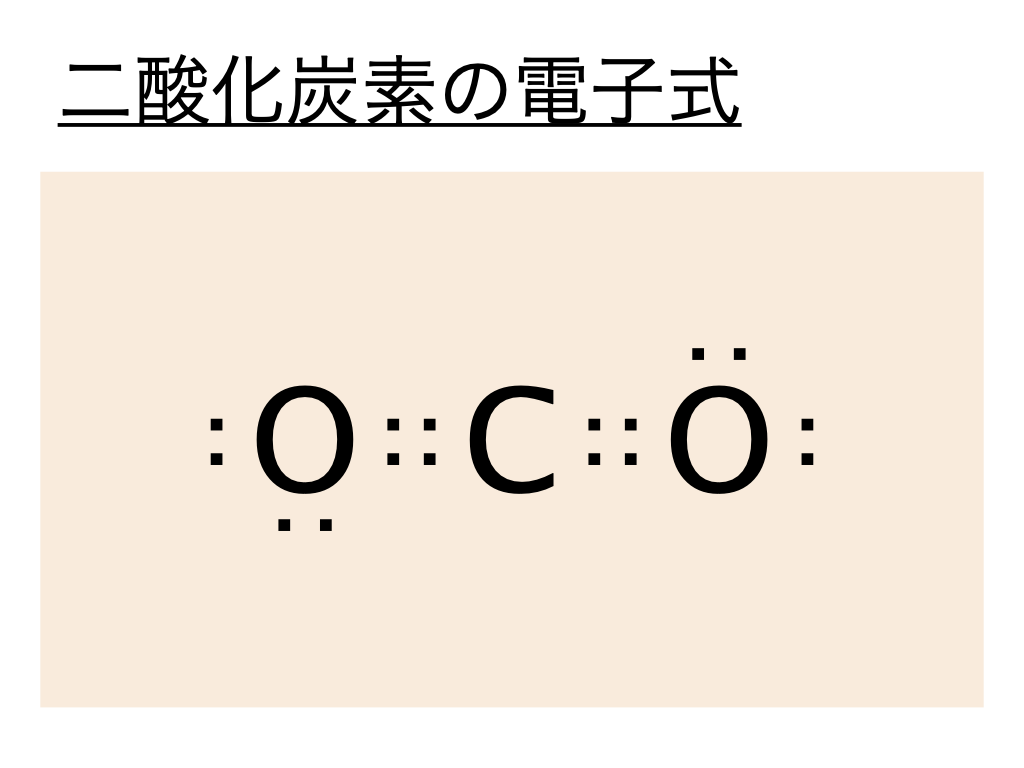
これは炭素Cの最外殻電子が4個、酸素Oの最外殻電子が6個であることからこのようになるのがわかるでしょう。
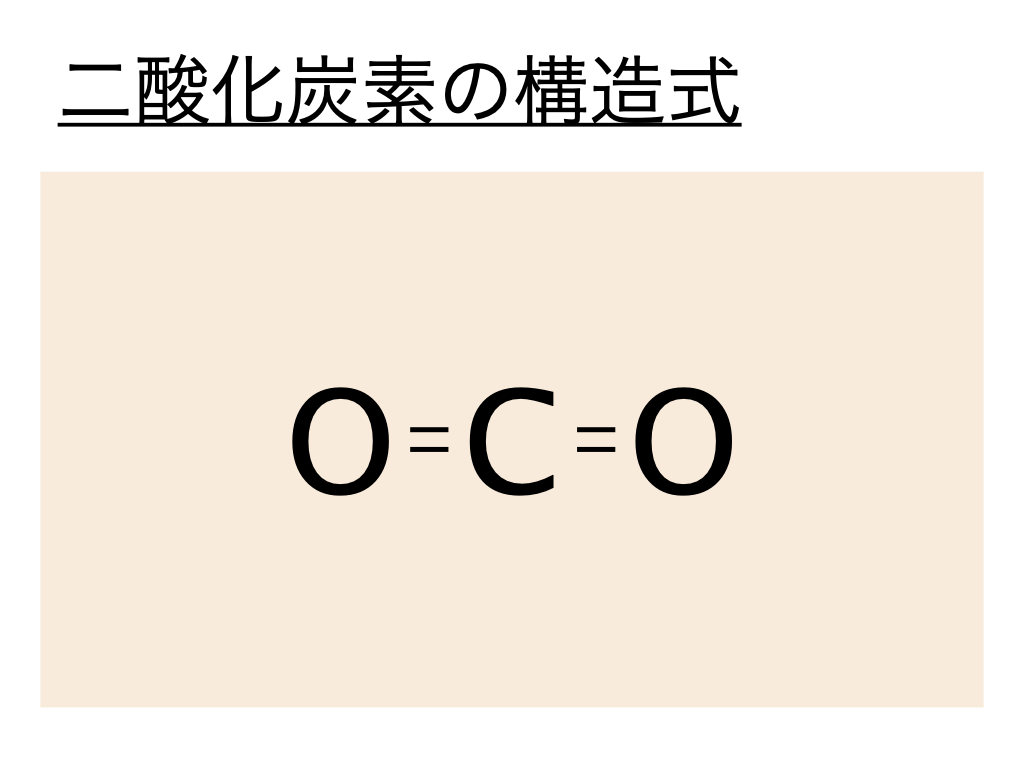
二酸化炭素の構造式はこの電子式を元に考えるといいのですが二酸化炭素の電子式では :(共有電子対)が酸素Oと炭素Cの間で各々重なっていることから二酸化炭素は各々が二重結合であることがわかります。
よって二酸化炭素(CO2)の構造式は以下のようになるのです。
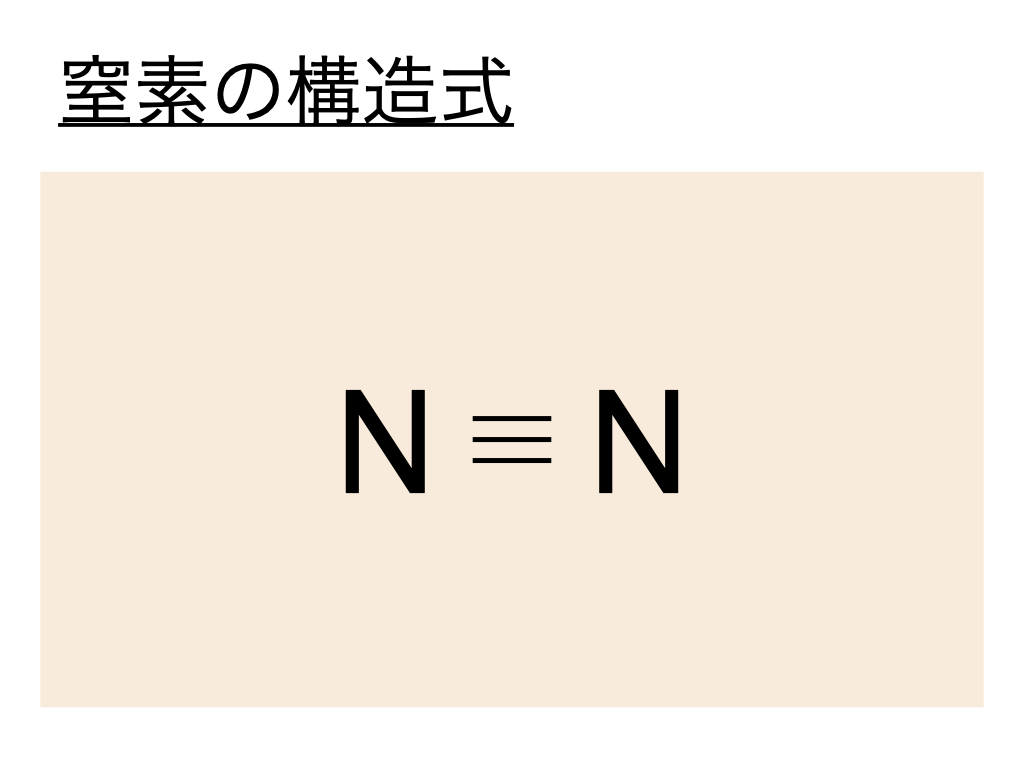
窒素の電子式と構造式【N2】
続いて空気成分の80%程を占める二原子分子である「窒素」の電子式と構造式を確認していきます。
窒素(N2)の電子式(ルイス構造式)は以下の通りとなります。

こちらは窒素Nの最外殻電子が5個であることから説明できます。
窒素の構造式はこの電子式を元に考えるとよく、窒素の電子式では :(共有電子対)が3つ重なっていることから三重結合であることがわかります。
よって窒素(N2)の構造式は以下のようになるのです。
酸素の電子式と構造式【O2】
続いて空気成分の20%程を占める二原子分子の「酸素」の電子式と構造式を確認していきます。
酸素(O2)の電子式(ルイス構造式)は以下の通りとなります。
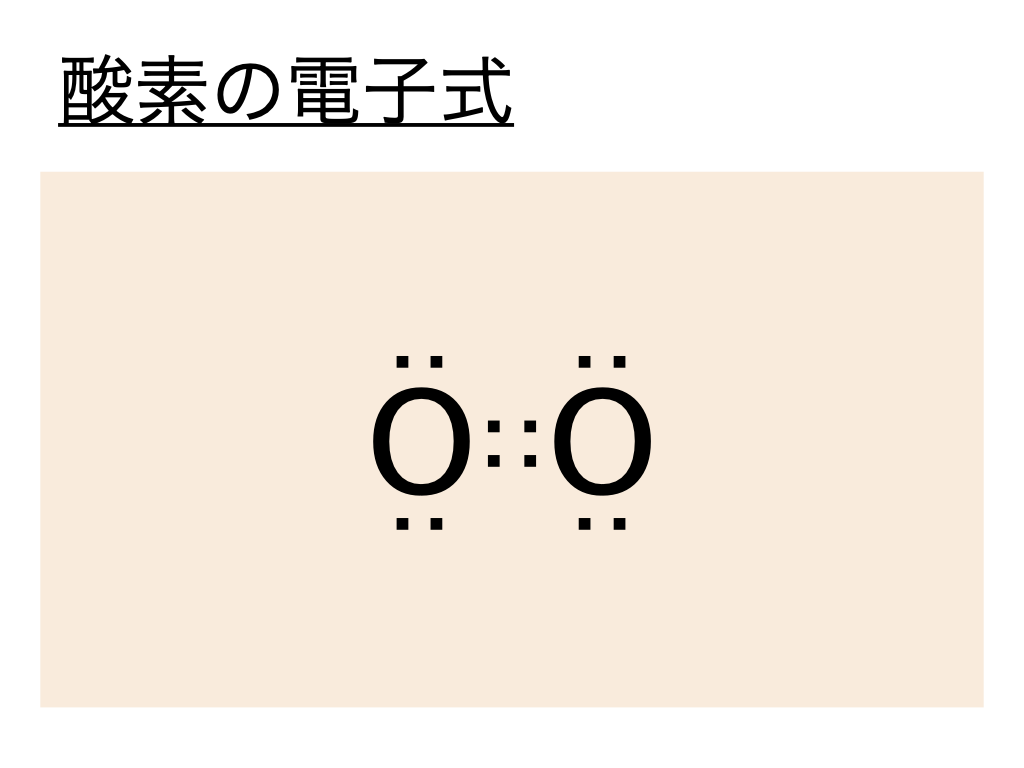
こちらは酸素Oの最外殻電子が6個であることから説明できます。
酸素の構造式はこの電子式を元に考えるとよく、酸素の電子式では :(共有電子対)が2つ重なっていることから二重結合であることがわかります。
よって酸素(O2)の構造式は以下のようになるのです。

水素の電子式と構造式【H2】
続いて窒素、酸素同様に二原子分子である「水素」の電子式と構造式を確認していきます。
水素(H2)の電子式(ルイス構造式)は以下の通りとなります。
※
こちらは水素Hの最外殻電子が1個であることから説明できます。
上と同様に水素の構造式はこの電子式を元に考えるとよく、水素の電子式では :(共有電子対)が重なっていないことから単結合であることがわかります。
よって水素(H2)の構造式は以下のようになるのです。
※
シアン化水素の電子式と構造式【HCN】
続いて多原子分子である「シアン化水素」の電子式と構造式を確認していきます。
シアン化水素(HCN)の電子式(ルイス構造式)は以下の通りとなります。
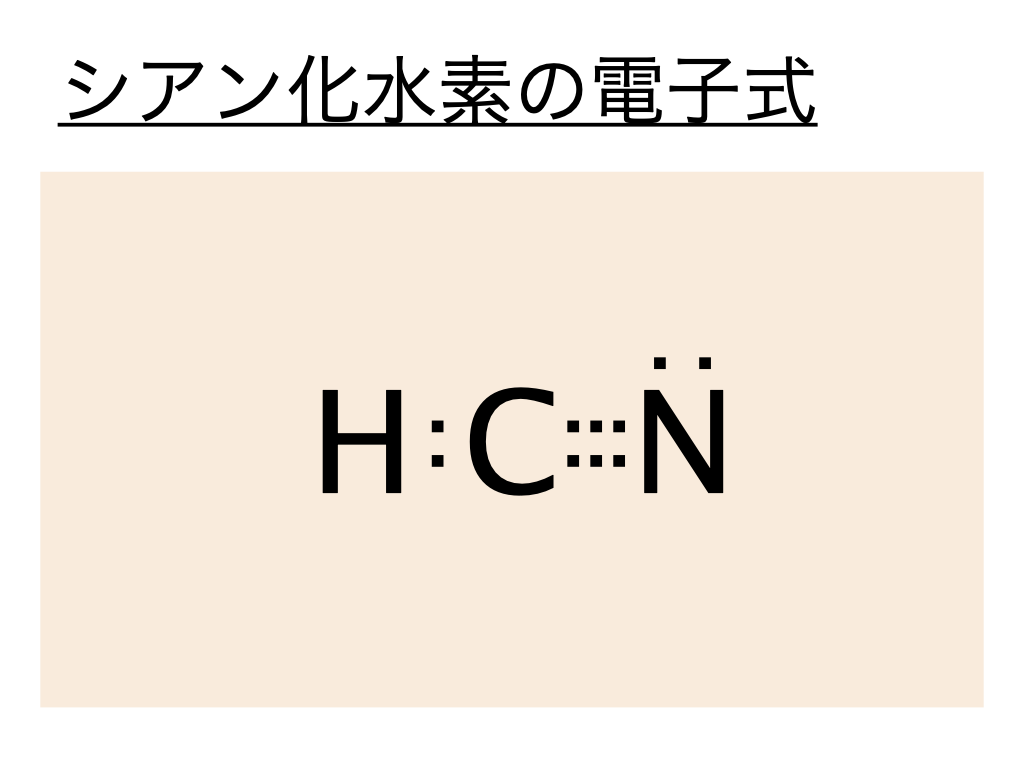
こちらは水素Hの最外殻電子が1個、炭素Cの最外殻電子が4個、窒素の最外殻電子が5個であることから説明できます。炭素は水素と共有電子対を作ることで電子の数は5つになります。閉殻にするには残り3つの電子を共有する必要があります。そのため窒素の電子を3つ共有します。そのため三重結合となります。その際に、窒素の電子は既に持っていた5個と炭素と共有した電子3個合わせて8個(閉殻)となっています。
上と同様にシアン化水素の構造式はこの電子式を元に考えるとよく、シアン化水素の電子式では水素と炭素の間の :(共有電子対)が1つであることから単結合であることがわかります。また炭素と窒素の間の:(共有電子対)が3つ重なっていることから三重結合であることがわかります。
よってシアン化水素(HCN)の構造式は以下のようになるのです。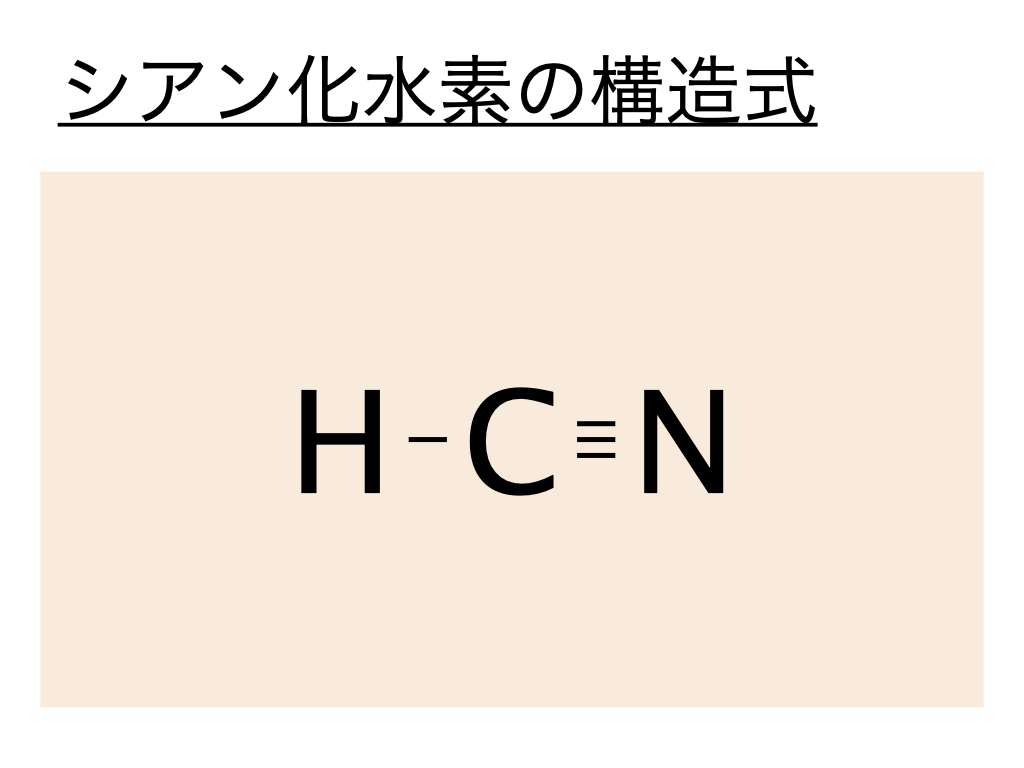
まとめ シアン化水素の電子式・構造式は?窒素・酸素・水素の電子式・構造式は?
常温にて気体(ガス)の代表といえるである二酸化炭素・窒素・酸素・水素・シアン化水素・一酸化炭素の電子式と構造式について解説しました。
電子式は丸暗記するというよりも構成元素の周りの電子数を理解し、それを元に考えると効率よく覚えられます。さらに各々の構造式はこの電子式を元に描くといいです。
各種電子式や構造式を覚え、化学をもっと好きになっていきましょう。

コメント