科学的な解析(化学)を行う際には基本的に反応物質の性質を理解しておくことが大切です。
ただ反応物質の性質といっても覚える量が多くなるため、まずは「物質の極性や水に溶けるかどうか」を学んでおくといいです。
中でもここでは「メタノールに極性があり水に溶ける理由」「エタノールに極性があり水にとける理由」について解説していきますので、参考にしてみてください。
メタノールに極性があるのはなぜ?【メタノールは極性分子?無極性分子?】
まずメタノールは極性分子であり、無極性分子ではありません。このメタノールに極性がある理由について以下で確認していきます。
「極性があるかどうか」を判断するためには、基本的に分子を構成する元素間に働く電気陰性度の差に着目するといいです。
電気陰性度とは簡単に説明しますと「電子を引きつける力の強さを示す指標」であり、この電気陰性度が大きいほど電子を引き寄せ、マイナスの電荷に帯びやすいと認識しておきましょう。
またすべての原子において全く同じ電気陰性度のものはないため、近い位置に存在する原子間には多かれ少なかれ「電気陰制度の差」は生じるものです。つまり近距離の違う原子間には、程度の差はあれ極性が必ずできるわけです。
例えばOH結合であれば、Oの方が電気陰性度が高いため以下のようにOの方に電子が引き寄せられます。
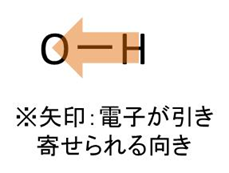
後は着目する分子の形によって、その物質に極性があるか・無極性かを判断できるといえます。
ここでメタノールに極性がある理由に話を戻します。メタノールの構造式は以下の通りです。
※
この時
・OH間の極性(電気陰性度の差)
・CO間の極性(電気陰性度の差)
が特にメタノール分子全体の極性と大きく関係しています。
ここで各々の電気陰性度は、炭素C:約2.5、酸素O:約3.5、水素H:約2.1であることから
・OH間の電気陰制度の差:約1.4
より、H方向からOに向かって電子が引き寄せられ、電気的な偏り(極性)が出来ているのがわかるでしょう。
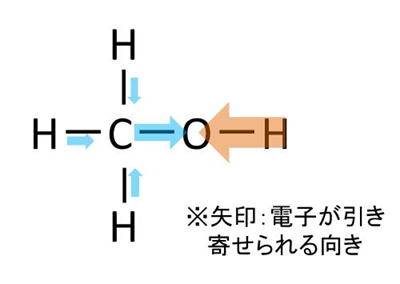
このような各原子間の電気陰性度の差と分子の形によって、メタノールに極性がある理由が説明できました。
また極性が近い物質では混ざる傾向が高いことから、メタノールは水に溶けることもわかるわけです(厳密にはいえないものの基本的に高校化学では極性が近い≒各々混ざりあうでOK。例外もあり)。
エタノールに極性があるのはなぜ?【エタノールは極性分子?無極性分子?】
続いてエタノールが極性分子であり、無極性分子でない理由についても確認していきます。
エタノールに極性がある理由としても上のよう
・分子の形状
によって説明できます。
メタノールとエタノールの構造の差としては、エタノールの方が炭素数が多くなったことが極性の有無を判断する上で注目すべきポイントです。
ただ炭素鎖が長くなったところでCC結合間には電気陰性度が働かないことから、メタノール同様にエタノールでもOH間の極性により、エタノール分子全体としても極性が残るのが明瞭です。
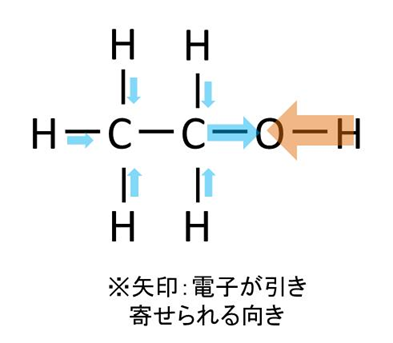
このような理由からエタノールに極性があることを確認できるのです。
また上にも記載の通り、極性が近い物質では混ざる傾向が高いことから、エタノールも水に溶けると説明できました。
まとめ エタノールに極性があるのはなぜ?水に溶ける理由は?
ここでは、メタンノールやエタノールに極性がある理由や水に溶ける理由について確認しました。
極性の有無を見分けるポイントは
・原子間の電気陰性度の差
・分子の形状
であり、水に溶けるかどうかは高校化学では基本的に極性の有無とほぼ一致していると認識しておくといいです。
さまざまな科学の知識を身に着け、日々の生活をもっと楽しんでいきましょう。
コメント