科学的な解析(化学)を行う際には基本的に反応物質の分子量や酸化数や電離式などの理解が必要となることが多いです。
そのためさまざまな物質の分子量や酸化数や電離式を理解しておくといいわけですが、あなた覚えられていますか。
ここでは代表的な化学物質のCO(一酸化炭素)に着目して、その分子式、構造式、電子式、分子構造、極性などをまとめていきますので、参考にしてみてください。
COの分子式(化学式)・構造式・電子式は?分子の形や極性は?【一酸化炭素】
まずはCO(一酸化炭素)の分子式(化学式)について確認していきます。
一酸化炭素の分子式(化学式)は炭素原子(C)1つと酸素原子(O)1つが結合しCOと表されます。

なお、一酸化炭素の基礎的な性質についてはこちらで詳しく解説していますので、参考にしてみてください。
COの構造式は?【一酸化炭素の構造式】
続いてCO(一酸化炭素)の構造式について見ていきましょう。
一酸化炭素(CO)の構造式は下記のように表されます。

炭素(C)と酸素(O)は共有結合で結合しており、三重結合となっているのがポイントです。理由については後の電子式で詳しく見ていきます。
COの電子式は?【一酸化炭素の電子式】
二酸化炭素は炭素(C)と酸素(O)が共有結合をしてできており、一酸化炭素の電子式は下記のように表されます。
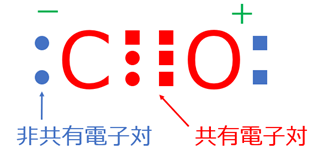
一酸化炭素分子では炭素(C)及び酸素(O)がそれぞれの間で3個ずつ不対電子を出し合い、3組の共有電子対を作っています。
このような3組の共有電子対による共有結合のことを、上述のよう「三重結合」といいます。
本来、炭素の価電子は4で酸素の価電子は6であるので、上記のように三重結合を形成するために、酸素の電子を1つ炭素に渡していると見ることが出来ます。
つまり炭素は電子を一つ受け取るので電荷が上がり負電荷(―)を生じ、酸素は電子を一つ渡すので電荷が下がり正電荷(+)を生じます。
COの分子の形は?【一酸化炭素の分子構造:立体構造】
さらにはCO(一酸化炭素)の分子の形についてもチェックしていきます。
一酸化炭素の分子構造は下記のように表されます。
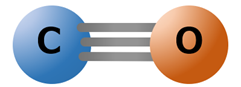
三重結合で炭素と酸素が結合された直線形状を構成しています。
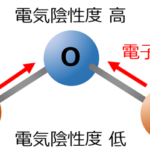
COの極性は?【一酸化炭素の極性】
一酸化炭素の極性を考える際は、下記の2点を考慮することになります。
- 三重結合により発生する電気的偏り
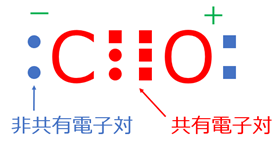
- 電気陰性度の差により発生する電気的偏り
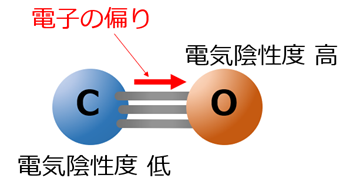
上記2点のそれぞれ逆の電気的偏りを生じることにより、電荷の偏りが相殺され、分子としての極性はほぼ無い(ほぼ無極性)といえる状態になります。
まとめ COの構造式・電子式や分子の形や極性は?【一酸化炭素】
ここまで一酸化炭素の分子式、構造式、電子式、分子構造、極性について考えてきました。
内容をまとめると、
- 一酸化炭素は炭素(C)と酸素(O)が結合した化合物である。
- 結合は3組の共有電子対を形成する三重結合で結合される。
- 分子形状は直線形状である。
- 炭素(C)と酸素(O)の三重結合の形成による電荷の方よりと電気陰性度の差による電子の偏りが発生するが、両者は分子内で相殺され、分子としての極性はほぼ無い(ほぼ無極性)。
一酸化炭素という物質は不完全燃焼する際に発生する物質で時々ニュースで耳にします。炭素と酸素でできている単純な物質ですが、結合及び電子配列等はしっかり理解が必要です。この機会に分子の構造や形状も含めて知っておくと理解が深まると思います。

コメント